某科研小组探究工业废Cu粉(杂质含有SiO2、Al2O3、Fe2O3中的一种或几种)的组成并制备少量CuSO4·5H2O,实现废物综合利用,实验过程如下:
过程Ⅰ:
(1)废Cu粉中一定含有的杂质是 (填化学式)
(2)写出过程②发生反应的离子方程式: 。
过程Ⅱ: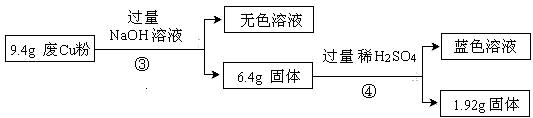
(3)综合过程Ⅰ、II,计算废Cu粉中各成分的质量之比是 (化为最简整数比)
过程Ⅲ:已知25℃时:
| 电解质 |
Cu(OH)2 |
Fe(OH)2 |
Fe(OH)3 |
| 溶度积(Ksp) |
2.2×10-20 |
8.0×10-16 |
4.0×10-38 |
| 开始沉淀时的pH |
5.4 |
6.5 |
3.5 |
| 完全沉淀时的pH |
6.4 |
9.6 |
4.0 |
(4)在Ⅱ中所得蓝色溶液中加入一定量的H2O2溶液,调节溶液的pH范围为 ,然后过滤、结晶,可得CuSO4·5H2O。
(5)下列与 Ⅲ方案 相关的叙述中,正确的是 (填字母)。
A.H2O2是绿色氧化剂,在氧化过程中不引进杂质、不产生污染
B.将Fe2+ 氧化为Fe3+ 的主要原因是Fe(OH)2沉淀比Fe(OH)3沉淀较难过滤
C.调节溶液pH选择的试剂可以是氢氧化铜或氧化铜
D.在pH>4的溶液中Fe3+一定不能大量存在


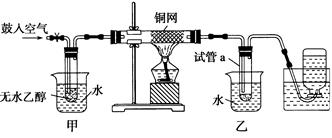
 CH3COOCH2CH2CH2CH3+H2O
CH3COOCH2CH2CH2CH3+H2O
 粤公网安备 44130202000953号
粤公网安备 44130202000953号