平衡指的是两个相反方向的变化最后所处的运动状态;中学阶段涉及的平衡有气体可逆反应的平衡、酸碱电离平衡、水解平衡及沉淀-溶解平衡等。
(1)现有容积为1 L的恒温恒容密闭容器,向其中加入2 mol A气体和2 mol B气体后发生如下反应:A(g)+B(g) C(g) △H=-a kJ·mol-1,20s后,反应达到平衡状态,生成1 mol C气体,放出热量Q1kJ。回答下列问题。
C(g) △H=-a kJ·mol-1,20s后,反应达到平衡状态,生成1 mol C气体,放出热量Q1kJ。回答下列问题。
①20s内B气体的平均化学反应速率为___________。
②下列各项中能说明该反应已经达到平衡状态的有 。
A.容器中气体的平均相对分子质量不随时间而变化
B.消耗1molA的同时消耗1molB
C.容器中气体的密度不随时间而变化
D.C的体积分数不随时间而变化
③保持容器温度和容积不变,若开始时向容器中加入2molC气体,反应达到平衡时,吸收热量Q2kJ,则Q1 与Q2的相互关系正确的是____________(填字母)。
(A)Q1 + Q2 = 2a (B) Q1 + 2Q2 < 2a (C)Q1 + 2Q2 > 2a(D)Q1 + Q2 < a
④在原平衡基础上,保持容器温度和容积不变,向容器中再通入bmolA气体,,重新达平衡后,B气体的转化率为60%,则b= 。
(2)亚磷酸(H3PO3)是二元酸,与足量NaOH溶液反应生成Na2HPO3。
25℃时H3PO3 H++H2PO的电离常数Ka=8.0×10-3 mol·L-1,该温度下NaH2PO3
H++H2PO的电离常数Ka=8.0×10-3 mol·L-1,该温度下NaH2PO3
水解反应的平衡常数Kh= mol·L-1。亚磷酸钠具有强还原性,可使碘水褪色。若向NaH2PO3溶液中加入少量I2,则溶液中 将 (填“变大”“变小”“不变”)。
将 (填“变大”“变小”“不变”)。
(3)下图为某温度下,PbS(s)、ZnS(s)、FeS(s)分别在溶液中达到沉淀溶解平衡后,溶液的S2-浓度、金属阳离子浓度变化情况。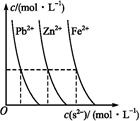
如果向三种沉淀中滴加盐酸,最先溶解的是 (填化学式)。向新生成的ZnS浊液中滴入足量含相同浓度的Pb2+、Fe2+的溶液,振荡后,ZnS沉淀会转化为 (填化学式)沉淀。
 2SO3(g)(正反应放热)
2SO3(g)(正反应放热)
 2HI(g)(正反应吸热)
2HI(g)(正反应吸热) [实验设计]控制
的初始浓度相同,恒定实验温度在298
或313
(其余实验条件见下表),设计如下对比试验。
[实验设计]控制
的初始浓度相同,恒定实验温度在298
或313
(其余实验条件见下表),设计如下对比试验。

 是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成:
是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成:
 粤公网安备 44130202000953号
粤公网安备 44130202000953号