铜是一种有色金属与人类关系非常密切。铜及其化合物在生产、生活中有广泛的应用。某同学对Cu的常见化合物的性质进行实验探究,研究的问题和过程如下:
(1)为探究不同价态铜的稳定性,进行如下实验:
向Cu2O中加适量稀硫酸,得到蓝色溶液和一种红色固体,该反应的离子化学方程式为_________;由此可知,在酸性溶液中,+2价Cu比+1价Cu更 (填“稳定”或“不稳定”)。
(2)硫酸铜是一种应用广泛的化工原料,实验室中可通过不同途径制取硫酸铜溶液和胆矾(CuSO4·5H2O),其中一种流程如图:
①杂铜(含少量有机物)灼烧后的产物除氧化铜还含少量铜,原因可能是________(填字母代号)。
a.该条件下铜无法被氧气氧化 b.灼烧不充分.铜未被完全氧化
c.氧化铜在加热过程中分解生成铜 d.灼烧过程中部分氧化铜被还原
②若将杂铜换为纯净的铜粉,可直接向其中加入稀硫酸和Fe2(SO4)3溶液,不断通入氧气。反应完全后向其中加入过量________(填化学式,下同),调节pH至 ,生成沉淀 ,过滤得硫酸铜溶液。已知:
| |
氢氧化物开始沉淀时的pH |
氢氧化物沉淀完全时的pH |
| Fe3+ |
2.7 |
3.7 |
| Fe2+ |
7.6 |
9.6 |
| Cu2+ |
4.7 |
6.7 |
(3)通过下述图1装置也可制取硫酸铜溶液(已知:2NaOH+2NO2=NaNO3+NaNO2+H2O)。
烧瓶内发生反应的化学方程式为__________________;
图2是图1的改进装置,
其优点有①____________________,②_________________ 。
(4)为测定CuSO4·5H2O晶体的纯度,进行下列实验:取a g试样配成l00 mL溶液,每次取20.00mL,消除干扰离子后,用b mol·L-1EDTA(Na2H2Y)标准溶液滴定其中的Cu2+(离子方程式为Cu2++H2Y2-=CuY2-+2H+),滴定至终点,平均消耗EDTA溶液l2.00 mL。(常温时,5%的Na2H2Y水溶液,其pH为4—6。)
①CuSO4·5H2O晶体的纯度是 。
②下列滴定方式中,最合理的是(夹持部分略去) (填序号)。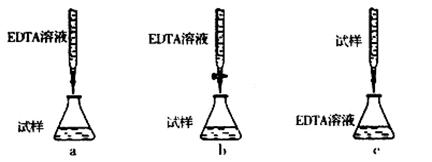
 三种离子,如果只取一次该溶液,分别用三种试剂将三种离子检验出来(要求每加入一种试剂能够检验出一种离子),假设所加试剂均为足量,则加入试剂的先后顺序为(写化学式):__________、__________、____________。
三种离子,如果只取一次该溶液,分别用三种试剂将三种离子检验出来(要求每加入一种试剂能够检验出一种离子),假设所加试剂均为足量,则加入试剂的先后顺序为(写化学式):__________、__________、____________。 _,9.8g H2SO4的物质的量是______mol, ______g的硫元素,______g的SO42-。
_,9.8g H2SO4的物质的量是______mol, ______g的硫元素,______g的SO42-。 密闭容器中,充入1 mol CO2和3 mol H2,一定条件下发生反应:CO2(g)+3H2(g)
密闭容器中,充入1 mol CO2和3 mol H2,一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH=-49.0kJ/mol
CH3OH(g)+H2O(g) ΔH=-49.0kJ/mol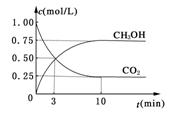
 ΔH=-1277 kJ·mol-1
ΔH=-1277 kJ·mol-1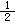 O2(g)=CO(g) ΔH=-110.5 kJ·mol-1
O2(g)=CO(g) ΔH=-110.5 kJ·mol-1 ,中国科学院长春应用化学研究所在甲醇燃料电池技术方面获得新突破,组装出了自呼吸电池及主动式电堆。甲醇燃料电池的工作原理如下图所示。
,中国科学院长春应用化学研究所在甲醇燃料电池技术方面获得新突破,组装出了自呼吸电池及主动式电堆。甲醇燃料电池的工作原理如下图所示。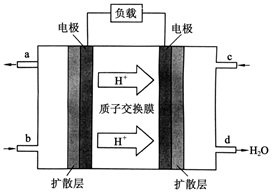

 粤公网安备 44130202000953号
粤公网安备 44130202000953号