(15分)KMnO4是常用的强氧化剂,工业上以软锰矿(主要成分MnO2)为原料,通过液相法生产,即在碱性条件下用氧气氧化MnO2得到K2MnO4,分离后得到K2MnO4,再用惰性材料为电极电解K2MnO4溶液得到KMnO4,简略生产过程如下:
(1)反应器中反应的化学方程式为: 。
(2)生产过程中最好使用含MnO280%以上的富矿,因为MnO2含量最低的贫矿中Al、Si的氧化物含量较高,会导致KOH消耗量 (填“偏高”或“偏低”),其中Al的氧化物和KOH溶液反应的化学方程式为: 。
(3)电解槽中阳极的电极反应方程式为: ;
(4)在传统工艺中得到K2MnO4后,向其中通入CO2制备KMnO4,化学反应方程式为:3K2MnO4+2CO2=2KMnO4+ MnO2+ 2K2CO3根据上述反应,从Mn元素的角度考虑KMnO4的产率最高为 。与该传统工艺相比,电解法的优势是 。
(5)测定高锰酸钾样品纯度的方法是:向高锰酸钾溶液中滴加硫酸锰溶液产生黑色沉淀,反应的离子方程式 。
(6)已知常温下KSP﹝Mn(OH)2﹞=2.0×10-23,工业上调节PH沉淀废水中的Mn2+,当pH=10时,
c(Mn2+)= mol/L。


 80多种工业以汞为原料,生产过程中产生的汞的污染越来越引起人们
80多种工业以汞为原料,生产过程中产生的汞的污染越来越引起人们 的重视,水体中的无机汞主要有Hg2+、Hg22+。
的重视,水体中的无机汞主要有Hg2+、Hg22+。 +可用KI及CuSO4溶液与其反应生成橙红色Cu2HgI4沉淀,用漫反射光谱直接测定汞沉淀物,该反应的离子方程式可表示为:。
+可用KI及CuSO4溶液与其反应生成橙红色Cu2HgI4沉淀,用漫反射光谱直接测定汞沉淀物,该反应的离子方程式可表示为:。 吸收总反应为:2Hg+SO2+8I一+4H+ =2HgI
吸收总反应为:2Hg+SO2+8I一+4H+ =2HgI +S+2H2O,最后进行电解吸收液(K2HgI4),阴极的电极反应式为:。
+S+2H2O,最后进行电解吸收液(K2HgI4),阴极的电极反应式为:。 化合物,沸点为77℃,在盛有10mL的锥形瓶中小心滴加8~10滴SOCl2,可观察到剧烈水解反应,液面有白雾和带有刺激性气味的气体逸出,该气体可使滴有品红试液的滤纸褪色.轻轻振荡锥形瓶,等白雾消
化合物,沸点为77℃,在盛有10mL的锥形瓶中小心滴加8~10滴SOCl2,可观察到剧烈水解反应,液面有白雾和带有刺激性气味的气体逸出,该气体可使滴有品红试液的滤纸褪色.轻轻振荡锥形瓶,等白雾消 失后,往溶液中滴加AgNO3溶液,有不溶于HNO3的白色凝乳状沉淀析出.
失后,往溶液中滴加AgNO3溶液,有不溶于HNO3的白色凝乳状沉淀析出. __.
__. 烧得不到无水AlCl3,而用SOCl2与AlCl3·H2O 混合共热,可得到无水AlCl3,其原因是 __________________________ __________________.
烧得不到无水AlCl3,而用SOCl2与AlCl3·H2O 混合共热,可得到无水AlCl3,其原因是 __________________________ __________________. A、B两种盐可发生下列变化,且B的焰色反应呈黄色(图中其它生成物未列出)
A、B两种盐可发生下列变化,且B的焰色反应呈黄色(图中其它生成物未列出)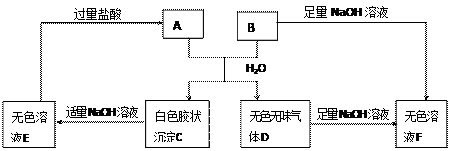


 粤公网安备 44130202000953号
粤公网安备 44130202000953号