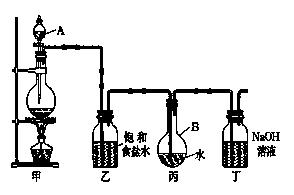
21.某中药主要含二硫化亚铁(FeS2),某学习小组欲用下图所示装置进行实验,测定其铁、硫元素的质量分数。
(1)装置中,A为高温灼烧装置,B为气体吸收装置,C为检测尾气中是否含有SO2的传感器。取m g该中药样品于装置A中,经充分反应,使硫元素全部转化为SO2和SO3,在B中得到白色沉淀,传感器(装置C)未检测到SO2。
① 装置B中的H2O2反应时表现出了 性。
② 欲计算硫元素的质量分数,需测量的数据是 。
③ 传感器的工作原理如下图所示。
传感器中阴极的电极反应式是 。
(2)为测定铁元素的质量分数,继续实验。
a.将A装置中的剩余固体用足量盐酸酸浸,有少量H2产生。充分反应后过滤,得到黄色滤液;
b.向滤液中滴加TiCl3溶液,至恰好完全反应,TiCl3被氧化为TiO2+;
c.用滴定法测定Fe2+的量,消耗v mL n mol/LK2Cr2O7溶液。
① a中滤液含有的金属阳离子是 。
② b中反应的离子方程式是 。
③ c中K2Cr2O7被还原为Cr3+,样品中铁元素质量分数的数学表示式是 。




 ________________________________________________________。
________________________________________________________。

 微粒符号表示 );
微粒符号表示 ); _______________________________________________________________________
_______________________________________________________________________
 粤公网安备 44130202000953号
粤公网安备 44130202000953号