(15分)高纯MnCO3是制备电讯器材、颜料、催化剂及高性能磁性材料的主要原料。实验室以MnO2为原料制备少量高纯MnCO3的操作步骤如下:

(1)制备MnSO4溶液:在三颈烧瓶中加入一定量MnO2和水,搅拌,通入SO2和N2混合气体,反应3h,停止通入SO2,继续反应片刻,过滤。
①依次写出烧瓶中和烧杯中反应的化学方程式为 、 。
②反应过程中,为使SO2尽可能转化完全,在通入SO2和N2比例一定,不改变固液投料的条件下,可采取的合理措施有 。
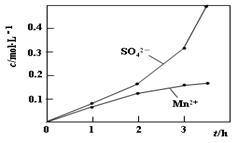
③若实验中将N2换成空气,测得反应液中Mn2+、SO42-的浓度随反应时间t变化如图。导致溶液中Mn2+、SO42-的浓度变化产生明显差异的主要原因是 。
(2)制备高纯MnCO3固体:已知MnCO3难溶于水和乙醇,潮湿时易被空气氧化,100℃开始分解;Mn(OH)2开始沉淀的pH=7.7。由(1)制得的MnSO4溶液制备高纯MnCO3的操作步骤如下[实验中可选用的试剂限制为:Ca(OH)2、NaHCO3、Na2CO3、C2H5OH]。

步骤①中为防止生成Mn(OH)2沉淀,注意 ;选择步骤②中所用试剂的理由是 ;步骤③是 。
(3)MnCO3在空气中加热易转化为不同价态的锰的氧化物,其固体残留率随温度的变化如图所示。
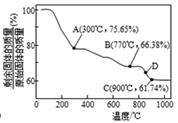
则加热至300℃时,发生反应的化学方程式为 ;图中点D对应固体的成分为 (填化学式)。







 粤公网安备 44130202000953号
粤公网安备 44130202000953号