已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数依次增大,其中A、B、C、D、E为不同主族的元素。A、C的最外层电子数都是其电子层数的2倍,B的电负性大于C,透过蓝色钴玻璃观察E的焰色反应为紫色,F的基态原子中有4个未成对电子。
(1)基态的F3+核外电子排布式是 。
(2)B的气态氢化物在水中的溶解度远大于A、C的气态氢化物,原因是 。
(3)化合物FD3是棕色固体、易潮解、100℃左右时升华,它的晶体类型是 ;该晶体的结构式是 ;化合物ECAB中的中的阴离子与AC2互为等电子体,该阴离子的电子式是 。


(4)FD3与ECAB溶液混合,得到含多种配合物的血红色溶液,其中配位数为5的配合物的化学式是 。
(5)化合物EF[F(AB)6]是一种蓝色晶体,右图表示其晶胞的 (E+未画出)。该蓝色晶体的一个晶胞中E+的个数为 。
(E+未画出)。该蓝色晶体的一个晶胞中E+的个数为 。
(6)B元素的具有18个电子的氢化物可用作火箭燃料,其原理是:B2O4(l)+2B2H4(l)=3B2(g)+4H2O(g),若反应中有1mol B的氢化物发生反应,则形成的π键有 mol。配合物Y的结构如图所示,Y中含
有 (填序号);

A.极性共价键 B.非极性共价键
C.配位键 D.氢键
Y中碳原子的杂化方式有 。
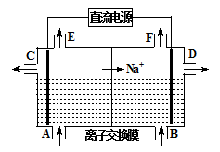
 O3+3H2O2。则阳极的电极反应式为 ,阴极的电极反应式为 。
O3+3H2O2。则阳极的电极反应式为 ,阴极的电极反应式为 。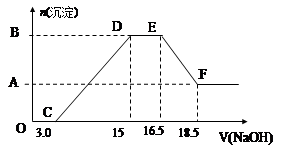
 ,常用作脱氯剂,该反应的离子方程式为_______________________;
,常用作脱氯剂,该反应的离子方程式为_______________________;
 粤公网安备 44130202000953号
粤公网安备 44130202000953号