H、C、N、Al、S、Cl是常见的六种短周期元素。
(1)Cl-的结构示意图为_____________;
(2)用“>”或“<”填空:
| 原子半径 |
气态氢化物的稳定性 |
酸性 |
| Al____ N |
CH4______NH3 |
H2SO4______HClO4 |
(3)含铝的某种盐常用作净水剂,该物质俗称________,其净水原理是________(用离子方程式表示)
(4)二氧化氯(ClO2)为一种黄绿色气体,是公认的高效、广谱安全的杀菌消毒剂。工业上制备ClO2的反应原理为:4HC1(浓)+2NaClO3=2ClO2↑+Cl2↑+2H2O+2NaCl。上述反应中,产生1molClO2,则被氧化的HC1为_____g。
(5)氢气是一种重要的清洁能源,但储存、运输很不方便。开发新型储氢材料是氢能利用的重要研究方向。已知NH3中氢原子可被锂原子替代,亚氨基锂(Li2NH)是一种良好的固体储氢材料,其储氢原理可表示为Li2NH+H2=LiNH2+LiH。下列有关说法不正确的是
A.此法储氢和钢瓶储氢的原理相同 B.LiH中的阳离子半径小于阴离子半径
C.Li2NH中N的化合价为-1价 D.该反应中H2既是氧化剂又是还原剂
(6)铝是一种重要的活泼金属,工业上可用于金属的冶炼。若9.0g铝与FeO在一定条件下完全反应放出144.0kJ热量,则Al和FeO发生铝热反应的热化学方程式为 _。
 ________________________。
________________________。 Na2CO3溶液与NaHCO3溶液,pH大小: Na2CO3_______NaHCO3(填>、=或<),两种溶液中微粒种类:Na2CO3_______NaHCO3(填>、=或<)。
Na2CO3溶液与NaHCO3溶液,pH大小: Na2CO3_______NaHCO3(填>、=或<),两种溶液中微粒种类:Na2CO3_______NaHCO3(填>、=或<)。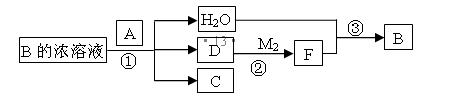
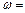 ______________(此空用数据列出表达式即可)。
______________(此空用数据列出表达式即可)。 粤公网安备 44130202000953号
粤公网安备 44130202000953号