工业上消除氮氧化物的污染,可用如下反应: CH4(g)+2NO2(g) N2(g)+CO2(g)+2H2O(g) ΔH=a kJ/mol 在温度T1和T2时,分别将0.50 mol CH4和1.2 mol NO2充入体积为1 L的密闭容器中,测得n(CH4)随时间变化数据如下表:
N2(g)+CO2(g)+2H2O(g) ΔH=a kJ/mol 在温度T1和T2时,分别将0.50 mol CH4和1.2 mol NO2充入体积为1 L的密闭容器中,测得n(CH4)随时间变化数据如下表: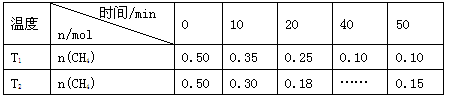
下列说法不正确的是
| A.10 min内,T1时CH4的化学反应速率比T2时小 |
| B.温度:T1<T2 |
| C.a < 0 |
| D.平衡常数:K(T1)<K(T2) |
工业上消除氮氧化物的污染,可用如下反应: CH4(g)+2NO2(g) N2(g)+CO2(g)+2H2O(g) ΔH=a kJ/mol 在温度T1和T2时,分别将0.50 mol CH4和1.2 mol NO2充入体积为1 L的密闭容器中,测得n(CH4)随时间变化数据如下表:
N2(g)+CO2(g)+2H2O(g) ΔH=a kJ/mol 在温度T1和T2时,分别将0.50 mol CH4和1.2 mol NO2充入体积为1 L的密闭容器中,测得n(CH4)随时间变化数据如下表:
下列说法不正确的是
| A.10 min内,T1时CH4的化学反应速率比T2时小 |
| B.温度:T1<T2 |
| C.a < 0 |
| D.平衡常数:K(T1)<K(T2) |