某化学兴趣小组对碳的氧化物做了深入的研究并取得了一些成果。
已知:C(s)+O2(g) 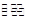 CO2(g) △H=-393kJ•mol-1;
CO2(g) △H=-393kJ•mol-1;
2CO (g)+O2(g) 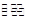 2CO2(g) △H=-566kJ•mol-1;
2CO2(g) △H=-566kJ•mol-1;
2H2(g)+O2(g)=2H2O(g) △H=-484kJ•mol-1
(1)将水蒸气喷到灼热的炭上实现炭的气化(制得CO、H2),该反应的热化学方程式为 。
(2))将一定量CO(g)和H2O(g)分别通入容积为1L的恒容密闭容器中,发生反应:
CO(g)+H2O(g)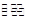 CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
| 实验组序 |
温度/℃ |
起始量/mol |
平衡量/mol |
达到平衡所需时间/min |
|
| H2O |
CO |
CO2 |
|||
| 1 |
500 |
4 |
8 |
3.2 |
4 |
| 2 |
750 |
2 |
4 |
0.8 |
3 |
| 3 |
750 |
2 |
4 |
0.8 |
1 |
①该反应的正反应为 (填“吸热”或“放热”)反应。
②实验1中,0~4min时段内,以v(H2)表示的反应速率 为 。
③实验2达到平衡时CO的转化率为 。
④实验3与实验2相比,改变的条件是 ;
请在下图坐标中画出“实验2”与“实验3”中c(CO2)随时间变化的曲线,并作必要的标注。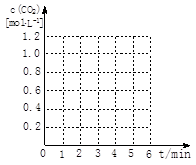
(3)在载人航天器中应用电化学原理,以Pt为阳极,Pb(CO2的载体)为阴极,KHCO3溶液为电解质溶液,还原消除航天器内CO2同时产生O2和新的能源CO,总反应的化学方程式为:2CO2 2CO+O2,若阳极为溶液中的OH-放电,则阳极的电极反应式为 。
2CO+O2,若阳极为溶液中的OH-放电,则阳极的电极反应式为 。
(4)将CO通入银氨溶液中可析出黑色的金属颗粒,其反应方程式为 。


 粤公网安备 44130202000953号
粤公网安备 44130202000953号