(8分)常温下,用0.1000 mol/L NaOH溶液分别滴定20.00 mL 0.1000 mol/L HCl溶液和
20.00 mL 0.1000 mol/L CH3COOH溶液,得到2条滴定曲线,如下图所示: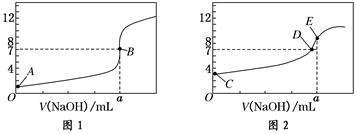
(1)由A、C点判断,滴定HCl溶液的曲线是______(填“图1”或“图2”);
(2)a=________ mL;
(3)c(Na+)=c(CH3COO-)的点是________;
(4)E点对应离子浓度由大到小的顺序为________________。
(8分)常温下,用0.1000 mol/L NaOH溶液分别滴定20.00 mL 0.1000 mol/L HCl溶液和
20.00 mL 0.1000 mol/L CH3COOH溶液,得到2条滴定曲线,如下图所示:
(1)由A、C点判断,滴定HCl溶液的曲线是______(填“图1”或“图2”);
(2)a=________ mL;
(3)c(Na+)=c(CH3COO-)的点是________;
(4)E点对应离子浓度由大到小的顺序为________________。