(10分)Ⅰ、可逆反应:aA(g) + bB(g) cC(g) + dD(g);根据图回答:
cC(g) + dD(g);根据图回答: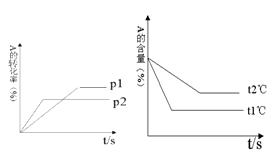
①压强 P1 P2;(a +b) (c +d)(填“>”或“<”下同)。
②温度t1℃ t2℃;△H 0。
③保持体积和温度不变,通入He,平衡会____移动(填“正向”、“逆向”或“不”)。
Ⅱ、写出下列元素基态原子的电子排布式:
①29Cu
②32Ge(简式)
(10分)Ⅰ、可逆反应:aA(g) + bB(g) cC(g) + dD(g);根据图回答:
cC(g) + dD(g);根据图回答:
①压强 P1 P2;(a +b) (c +d)(填“>”或“<”下同)。
②温度t1℃ t2℃;△H 0。
③保持体积和温度不变,通入He,平衡会____移动(填“正向”、“逆向”或“不”)。
Ⅱ、写出下列元素基态原子的电子排布式:
①29Cu
②32Ge(简式)