(本题共12分)用海水可同时生产氯化钠和金属镁或镁的化合物,其流程如下图所示:
36、在实验室中由粗盐“重结晶”制精盐的操作包括溶解、过滤、蒸发、_________、洗涤等步骤;有关其中“蒸发”步骤的叙述错误的是____________。
a. 蒸发的目的是得到热饱和溶液
b. 蒸发的目的是析出晶体
c. 应用余热蒸干溶液
d. 应蒸发至有较多晶体析出时为止
37、由MgCl2溶液得到MgCl2·6H2O也需要蒸发,根据溶解度曲线,蒸发的目的是_________。
a. 得到热饱和溶液 b. 析出晶体
38、若在空气中加热MgCl2·6H2O,生成的是Mg(OH)Cl,写出反应的化学方程式:___________________;用电解法制取金属镁时,需要无水氯化镁。在干燥的HCl气流中加热MgCl2·6H2O时,能得到无水MgCl2,其原因是_______________________________________________________________。
39、该流程产生的物质中,除Ca2+能被海洋生物利用外,还需综合利用的物质是_________。
40、MgCl2可电解制Mg,MgO则是重要的耐火材料。在550℃时,MgCl2·6H2O会分解生成MgO、MgCl2、HCl和水,若不补充其它原料,使一定量的MgCl2·6H2O全部生成a mol MgO、b mol MgCl2和36.5%的盐酸,则a:b≈______________(取整数值)。

 与
与 ;②O2与O3;③正丁烷和异丁烷;④金刚石和石墨;⑤冰与水;⑥CH3CH2OH和CH3OCH3;⑦H2与D2。
;②O2与O3;③正丁烷和异丁烷;④金刚石和石墨;⑤冰与水;⑥CH3CH2OH和CH3OCH3;⑦H2与D2。
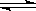 2HF
2HF
 粤公网安备 44130202000953号
粤公网安备 44130202000953号