亚氯酸钠(NaClO2)是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业。它
在碱性环境中稳定存在。工业设计生产NaClO2的主要流程如图所示。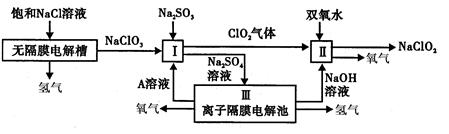
另附III离子交换膜电解池示意图。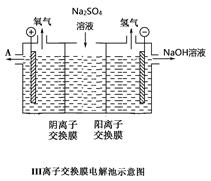
(1)写出无隔膜电解槽阳极反应的电极反应式:__________
(2)由离子交换膜电解池示意图分析A的化学式是__________
(3)Ⅱ中反应的离子方程式是__________
(4)设备Ⅲ在通电电解前,检验其溶液中主要阴离子的方法、步骤、现象是__________
亚氯酸钠(NaClO2)是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业。它
在碱性环境中稳定存在。工业设计生产NaClO2的主要流程如图所示。
另附III离子交换膜电解池示意图。
(1)写出无隔膜电解槽阳极反应的电极反应式:__________
(2)由离子交换膜电解池示意图分析A的化学式是__________
(3)Ⅱ中反应的离子方程式是__________
(4)设备Ⅲ在通电电解前,检验其溶液中主要阴离子的方法、步骤、现象是__________