(8分)甲、乙、丙三种物质之间有如下转化关系: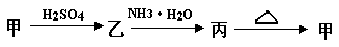
(1)若甲是不溶于水的白色固体物质,既能溶于盐酸又能溶于氢氧化钠溶液,则甲是____________;写出 乙→丙转化的化学方程式___________________________。
(2)若乙溶液中加入KSCN溶液,有红色出现,则甲物质是__________________________;
写出甲→乙转化的离子方程式_______________________________________。
(8分)甲、乙、丙三种物质之间有如下转化关系: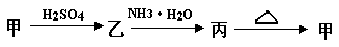
(1)若甲是不溶于水的白色固体物质,既能溶于盐酸又能溶于氢氧化钠溶液,则甲是____________;写出 乙→丙转化的化学方程式___________________________。
(2)若乙溶液中加入KSCN溶液,有红色出现,则甲物质是__________________________;
写出甲→乙转化的离子方程式_______________________________________。