某兴趣小组在研究性学习中设计了如下实验来探究Fe和H2SO4反应的过程,装置如下图所示。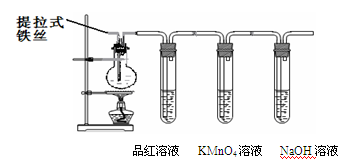
①在烧瓶中加入浓硫酸。
②将提拉式铁丝插入溶液中,观察到有少量气泡,后停止的现象。
③加热烧瓶至有大量气体 产生时停止加热,品红溶液颜色褪去,烧瓶中溶液变为棕黄色。
④一段时间后KMnO4溶液颜色不再变浅,但NaOH 溶液中仍有气体放出,在导管口处可点燃此气体,烧瓶中液体变为浅绿色
根据以上实验回答:
由步骤②的现象可得出的结论是:
在步骤③中,品红溶液褪色的原因是
写出步骤④中,使溶液变为浅绿色的可能的原因是 (用离子方程式表示);
(4)KMnO4溶液褪色的化学方程式 。
(5)设计实验证明反应后的溶液中只有Fe2+ (答操作和现象)
(6)若在反应中铁丝质量减少a克,并收集到bL可燃性气体(标准状况下假设无体积损失),则在反应过程中产生的使品红溶液褪色的气体的质量是 (用含a、b数学表达式表示)
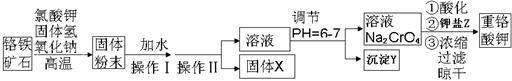

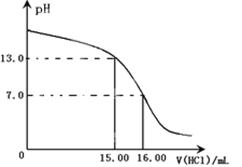
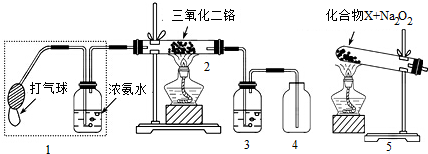

 粤公网安备 44130202000953号
粤公网安备 44130202000953号