(10分)某化学兴趣小组进行如下图所示的电化学实验,实验前查资料获知:铁氰化钾
(K3[Fe(CN)6])遇Fe2+产生 蓝色沉淀。V形管以多孔Pt为电极;U形管A端滴入1~2滴K3[Fe(CN)6]溶液。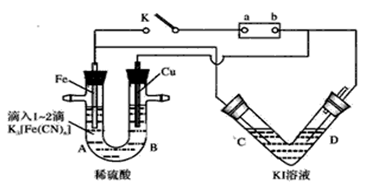
(1)开始时,接通K电键:U形管中无沉淀,可知电源正极为 (填“a”或“b”).Fe电极上发生的电极反应为 。
(2)断开K电键,V形管中为将 能转化为 能的装置;U形管A端现象为 。
(10分)某化学兴趣小组进行如下图所示的电化学实验,实验前查资料获知:铁氰化钾
(K3[Fe(CN)6])遇Fe2+产生 蓝色沉淀。V形管以多孔Pt为电极;U形管A端滴入1~2滴K3[Fe(CN)6]溶液。
(1)开始时,接通K电键:U形管中无沉淀,可知电源正极为 (填“a”或“b”).Fe电极上发生的电极反应为 。
(2)断开K电键,V形管中为将 能转化为 能的装置;U形管A端现象为 。