下列有关说法正确的是
A.已知:HI(g) 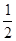 H2(g)+ H2(g)+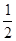 I2(s) △H =-26.5kJ/mol,由此可知1mol HI气体在密闭容器中充分分解后可以放出26.5kJ的热量 I2(s) △H =-26.5kJ/mol,由此可知1mol HI气体在密闭容器中充分分解后可以放出26.5kJ的热量 |
| B.已知:2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ/mol,则氢气的燃烧热为ΔH=-285.8 kJ/mol |
| C.肼(N2H4)是一种用于火箭或燃料电池的原料,已知 2H2O(g)+ O2(g)=2H2O2(l)△H=+108.3kJ/mol① N2H4(l) + O2(g)=N2(g) + 2H2O(g)△H=-534.0kJ/mol② 则有反应:N2H4(l) + 2 H2O2(l) =N2(g)+ 4H2O(l)△H=-642.3kJ/mol |
| D.含20.0 g NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量,则稀醋酸和稀NaOH溶液反应的热化学方程式为:NaOH(aq)+CH3COOH(aq) = CH3COONa(aq)+H2O(l)ΔH=-57.4 kJ/mol |


 粤公网安备 44130202000953号
粤公网安备 44130202000953号