有一包固体粉末,由CaCO3、Na2SO4、KNO3、BaCl2、CuSO4中的三种物质组成,取样品进行如下实验:
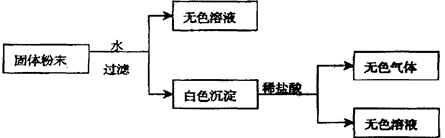
从实验可以判断,该固体粉末中
(1)一定不含有 ,
(2)它的组成可能是 或 。
(3)加入盐酸后发生反应的离子方程式为 。
(4)要进一步确定其组成还应进行的实验操作是 。
有一包固体粉末,由CaCO3、Na2SO4、KNO3、BaCl2、CuSO4中的三种物质组成,取样品进行如下实验:

从实验可以判断,该固体粉末中
(1)一定不含有 ,
(2)它的组成可能是 或 。
(3)加入盐酸后发生反应的离子方程式为 。
(4)要进一步确定其组成还应进行的实验操作是 。