相同温度下,体积均为1.5 L的两个恒容容器中发生可逆反应:
X2 (g+3Y2(g)  2XY3(g) ΔH=-92.6 kJ·mol-1,实验测得有关数据如下表:
2XY3(g) ΔH=-92.6 kJ·mol-1,实验测得有关数据如下表:
| 容器编号 |
起始时各物质物质的量/mol |
达平衡时体系能量的变化 |
||
| X2 |
Y2 |
XY3 |
||
| ① |
1 |
3 |
0 |
放热46.3 kJ |
| ② |
0.8 |
2.4 |
0.4 |
Q(Q>0) |
下列叙述不正确的是( )
A.容器①中达到平衡时,Y2的转化率为50%
B.Q="27.78" kJ
C.若容器①体积改为1.0 L.则达平衡时放出的热量大于46.3 kJ
D.容器①、②中反应的平衡常数相等,K=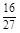

 g铝粉跟一定量的金属氧化物粉末混合形成铝热剂。发生铝热反应之后,所得固体中含金属单质为18g,则该氧化物粉末可能是
g铝粉跟一定量的金属氧化物粉末混合形成铝热剂。发生铝热反应之后,所得固体中含金属单质为18g,则该氧化物粉末可能是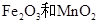 B.
B.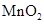 和
和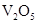
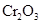 和
和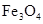 和FeO
和FeO 粤公网安备 44130202000953号
粤公网安备 44130202000953号