I.还原剂还原法、光催化氧化法、电化学吸收法是减少氮氧化物排放的有效措施。
(1)利用炭粉可以将氮氧化物还原。
已知:N2(g)+O2(g)=2NO(g) ΔH=+180.6 kJ·mol-1
C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ·mol-1
反应:C(s)+2NO(g)=CO2(g)+N2(g) ΔH=_____kJ·mol-1。
(2)TiO2在紫外线照射下会使空气中的某些分子产生活性基团OH,OH能将NO、NO2氧化,如下图所示,OH与NO2的反应为NO2+OH=HNO3。
写出OH与NO反应的化学方程式:_____________。
II.甲醇、乙醇是重要的有机化工原料,有着重要的用途和应用前景。
(3)若在恒温恒容的容器内进行反应CO(g)+2H2(g) CH3OH(g),则可用来判断该反应达到平衡状态的标志有 (填字母)。
CH3OH(g),则可用来判断该反应达到平衡状态的标志有 (填字母)。
| A.H2百分含量保持不变 |
| B.容器中气体的压强保持不变 |
| C.容器中混合气体的密度保持不变 |
| D.2v(H2)正= v(CH3OH )逆 |
(4)CO(g)+2H2(g) CH3OH(g) 其平衡常数表达式为K=___________。该反应的平衡常数K 随温度T 的变化如图所示,
CH3OH(g) 其平衡常数表达式为K=___________。该反应的平衡常数K 随温度T 的变化如图所示,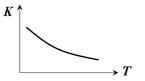
则该反应的 △H 0。(填“>”、“<”或“=”)。已知该反应在300℃时的化学平衡常数为0.27,该温度下将2 mol CO、3 mol H2和2 mol CH3OH充入容积为2 L的密闭容器中,此时反应将 (填“向正反应方向进行”、“向逆反应方向进行”或“处于平衡状态”)。
(5)下图所示是一种酸性燃料电池乙醇检测仪,具有自动吹气流量侦测与控制的功能,适合进行现场乙醇检测。负极反应式为_________。
 CO2(g)+H2(g)
CO2(g)+H2(g)  有;
有; 实验
实验
 粤公网安备 44130202000953号
粤公网安备 44130202000953号