下表为元素周期表的一部分,参照元素①~⑩在表中的位置,请用化学用语作答:
族
周期
|
IA
|
|
0
|
1
|
①
|
ⅡA
|
ⅢA
|
ⅣA
|
ⅤA
|
ⅥA
|
ⅦA
|
|
2
|
|
②
|
|
|
③
|
④
|
⑤
|
|
3
|
⑥
|
|
⑦
|
|
⑧
|
⑨
|
⑩
|
|
(1)⑤、⑥、⑦的离子半径由大到小的顺序为。(填离子符号)
(2)⑧、⑨、⑩的最高价含氧酸的酸性由强到弱为。(用化学式表示)
(3)写出⑥在空气中加热生成的产物的电子式:。
(4)由表中元素形成的物质可发生下图中的反应,其中B、C、G是单质,B为黄绿色气体,D溶液显碱性。
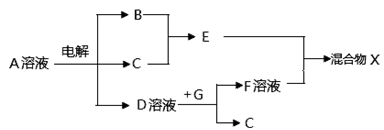
①写出D溶液与G反应的化学方程式。
②混合物X中的某物质不溶于水,但既能溶于酸又能溶于碱,请写出它在碱性溶液中的电离方程式。
(5)已知某些不同族元素的性质也有一定的相似性,如元素②与元素⑦的氢氧化物有相似的性质。写出元素②的氢氧化物与NaOH溶液反应的离子方程式:。
(6)砷(As)的化合物可用于杀虫及医疗。
①As的原子结构示意图为。
②Y由④⑥⑩三种元素组成,是生活中常见的消毒剂。As可与Y的水溶液反应,产物有As的最高价含氧酸,该反应的化学方程式为。