(本题共10分)研究燃料的燃烧和对污染气体产物的无害化处理,对于防止大气污染有重要意义。
(1)将煤转化为清洁气体燃料。已知:
H2(g)+1/2O2(g)=H2O(g) 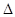 H= −242.0 kJ/mol
H= −242.0 kJ/mol
C(s)+1/2O2(g)=CO(g) 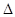 H= −110.0 kJ/mol
H= −110.0 kJ/mol
①写出焦炭与水蒸气反应制H2和CO的热化学方程式 。
②已知在101kPa时,CO、H2和CH4的燃烧热分别为283kJ/mol、286 kJ/mol和892kJ/mol。则反应CH4(g)+ H2O(g)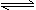 CO(g)+3H2(g)△H= kJ/mol。
CO(g)+3H2(g)△H= kJ/mol。
(2)已知一定温度和压强下,由H2和CO反应合成优质燃料甲醇:
CO(g)+2H2(g)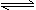 CH3OH(g)△H=-91kJ/mo1
CH3OH(g)△H=-91kJ/mo1
①在相同条件下要想得到182kJ热量,加入各物质的物质的量可能是 。
| A.2mo1 CO和4mol H2 | B.2mo1 CO、4mol H2和1mol CH3OH(g) |
| C.4mo1 CO和4mol H2 | D.4mo1 CO和6mol H2 |
②将1mol CO和2mol H2充入一密闭容器中,保持恒温恒压时进行反应,达到平衡时,测得CO的转化率为20%。若在相同条件下,起始时在该容器中充入1mol CH3OH(g),反应达到平衡时的热量变化是 (填“吸收”或“放出”) kJ热量。



 2NH3(g) △H=-93 kJ·mol-1。试根据表中所列键能数据计算a的数值:_______________。
2NH3(g) △H=-93 kJ·mol-1。试根据表中所列键能数据计算a的数值:_______________。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号