(1)常温下,向100 mL 0.01 mol·L-1HA溶液中逐滴加入 0.02 mol·L-1MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计)。回答下列问题: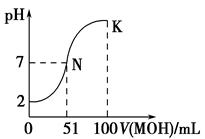
①由图中信息可知HA为________(填“强”或“弱”),理由是___________。
②常温下一定浓度的MA稀溶液的pH=a,则a________7(填“>”、“<”或“=”)。
③请写出K点所对应的溶液中离子浓度的大小关系: 。
(2)已知25 ℃时0.1 mol·L-1醋酸溶液的pH约为3,向其中加入醋酸钠晶体,等晶体溶解后发现溶液的pH增大。对上述现象有两种不同的解释:甲同学认为醋酸钠水解呈碱性,增大了c(OH-),因而溶液的pH增大;乙同学认为醋酸钠溶于水电离出大量醋酸根离子,抑制了醋酸的电离,使c(H+)减小,因此溶液的pH增大。
①为了验证上述哪种解释正确,做如下实验:向0.1 mol·L-1的醋酸溶液中加入少量下列物质中的________(填写编号),然后测定溶液的pH。
| A.固体CH3COOK | B.固体CH3COONH4 |
| C.气体NH3 | D.固体NaHCO3 |
②若乙的解释正确,溶液的pH应________(填“增大”“减小”或“不变”)。
 Fe(OH)3+3HCl △H>0。
Fe(OH)3+3HCl △H>0。 ,各形态的浓度分数α随溶液pH变化的关系如下图所示:
,各形态的浓度分数α随溶液pH变化的关系如下图所示:
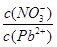 ________2(填“>”“=”或“<”);往该溶液中滴入氯化铵溶液后,
________2(填“>”“=”或“<”);往该溶液中滴入氯化铵溶液后, E2Pb(s)+2H+则脱铅的最合适pH范围为( )
E2Pb(s)+2H+则脱铅的最合适pH范围为( ) Ag+(aq)+X-(aq)
Ag+(aq)+X-(aq) 粤公网安备 44130202000953号
粤公网安备 44130202000953号