(14分)化学反应原理在科研和工农业生产中有广泛应用。
(1)某化学兴趣小组进行工业合成氨的模拟研究,反应的方程式为N2(g)+3H2(g)  2NH3(g) ΔH<0。在lL密闭容器中加入0.1 mol N2和0.3mol H2,实验①、②、③中c(N2)随时间(t)的变化如下图所示:
2NH3(g) ΔH<0。在lL密闭容器中加入0.1 mol N2和0.3mol H2,实验①、②、③中c(N2)随时间(t)的变化如下图所示: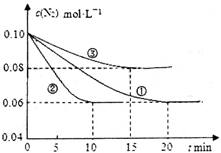
实验②从初始到平衡的过程中,该反应的平均反应速率v(NH3)=__________________;与实验①相比,实验②和实验③所改变的实验条件分别为下列选项中的__________、__________(填字母编号)。
A.增大压强
B.减小压强
C.升高温度
D.降低温度
E.使用催化剂
(2)已知NO2与N2O4可以相互转化:2NO2(g) N2O4(g)。
N2O4(g)。
①T℃时,将0.40 mol NO2气体充入容积为2L的密闭容器中,达到平衡后,测得容器中c(N2O4)="0.05" mol/L,则该反应的平衡常数K=_______________;
②已知N2O4在较高温度下难以稳定存在,易转化为NO2,若升高温度,上述反应的平衡常数K将_____________(填“增大”、“减小”或“不变”)。
③向绝热密闭容器中通入一定量的NO2,某时间段内正反应速率随时问的变化如图所示。下列说法正确的是__________(填字母编号)。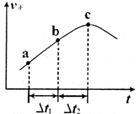
A.反应在c点达到平衡状态
B.反应物浓度:a点小于b点
C.Δt1=Δt2时,NO2的转化率:a~b段小于 b~c段
(3)25℃时,将amol/L的氨水与b mol/L盐酸等体积混合,反应后溶液恰好显中性,则a______b。 (填“>”、“<”或“=”);用a、b表示NH3 H2O的电离平衡常数Kb=________________。
H2O的电离平衡常数Kb=________________。
 2SO3(g),写出该反应的化学平衡常数表达式:
2SO3(g),写出该反应的化学平衡常数表达式:
 H++SO42-
H++SO42- H++SO42
H++SO42 粤公网安备 44130202000953号
粤公网安备 44130202000953号