| 化学式 |
NH3·H2O |
HCN |
CH3COOH |
H2CO3 |
| 电离平衡常数(25℃) |
Kb=1.77×10-5 |
Ka=4.93×10-10 |
Ka=1.76×10-5 |
Ka1=4.30×10-7 Ka2=5.61×10-11 |
(1)电离平衡常数是衡量弱电解质电离程度强弱的量。上表中给出几种弱电解质的电离平衡常数,从中可以判断:在相同温度下,同浓度的三种酸溶液的导电能力由大到小的顺序为 。
(2)盐类水解程度的强弱同样与弱电解质的电离程度有一定联系,结合表中数据回答下列问题:
①25℃时,有等浓度的a.NaCN溶液、b.Na2CO3溶液、c.CH3COONa溶液,三种溶液的pH由大到小的顺序为 。(填溶液前序号)
②浓度相同的NaCN溶液与CH3COOK溶液相比,c(Na+)-c(CN-) c(K+)-c(CH3COO-)。(填“>”、“<”或“=”)
③将等体积等物质的量浓度的盐酸和氨水混合后,溶液呈 性(填“酸”、“碱”或“中”),用离子方程式表示原因 。
④室温下,若将0.1 mol·L-1盐酸滴入20 mL 0.1 mol·L-1氨水中,溶液pH随加入盐酸体积的变化曲线如下图所示。b点所示溶液中的溶质是 。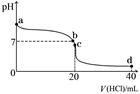
⑤NH4HCO3溶液呈 性(填“酸”、“碱”或 “中”)。
(3)结合表中数据,向NaCN溶液中通入少量CO2,所发生反应的化学方程式 。
 4AlCl3+3O2 ↑。请回答下列问题:
4AlCl3+3O2 ↑。请回答下列问题: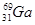 ,其原子在天然同位素原子中所占的百分比为60%。实验测得溴化镓(GaBr3)的摩尔质量为309.8 g/mol,则由此推知镓的另一种同位素是_________。
,其原子在天然同位素原子中所占的百分比为60%。实验测得溴化镓(GaBr3)的摩尔质量为309.8 g/mol,则由此推知镓的另一种同位素是_________。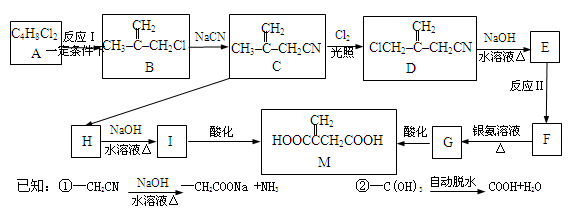
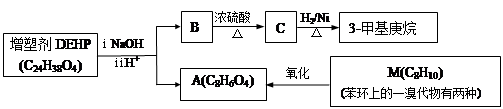
 2Cl2+2H2O,可实现氯的循环利用。
2Cl2+2H2O,可实现氯的循环利用。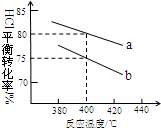
 粤公网安备 44130202000953号
粤公网安备 44130202000953号