(12分)如图装置闭合电键时,电流计A的指针将发生偏转。试回答下列问题。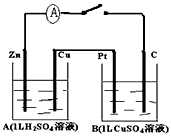
(1)A池是____________;Zn的电极名称是____________;B池是____________;
Pt的电极名称是____________(填电解池、原电池、阴、阳、正、负极等)
(2)写出下列有关反应:C极上电极反应:_________________
(3)B池中的总反应的化学方程式为________________________
(12分)如图装置闭合电键时,电流计A的指针将发生偏转。试回答下列问题。
(1)A池是____________;Zn的电极名称是____________;B池是____________;
Pt的电极名称是____________(填电解池、原电池、阴、阳、正、负极等)
(2)写出下列有关反应:C极上电极反应:_________________
(3)B池中的总反应的化学方程式为________________________