(15分)CH4和CO2反应可以制造价值更高的化学产品。
(1)250℃时,以镍合金为催化剂,向4 L容器中通入6 mol CO2、4mol CH4,发生反应:CO2(g)+CH4(g) 2CO(g)+2H2(g)。平衡体系中各组分的浓度为:
2CO(g)+2H2(g)。平衡体系中各组分的浓度为:
| 物 质 |
CH4 |
CO2 |
CO |
H2 |
| 平衡浓度(mol·L-1) |
0.5 |
1.0 |
1.0 |
1.0 |
①在该条件下达平衡时,CH4的转化率为____________________。
②已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H1 kJ·mol-1
CO(g)+H2O (g)=CO2(g)+H2(g) △H2 kJ·mol-1
2CO(g)+O2(g)=2CO2(g) △H3 kJ·mol-1
求反应CO2(g)+CH4(g) 2CO(g)+2H2(g) 的 △H=_______________kJ·mol-1
2CO(g)+2H2(g) 的 △H=_______________kJ·mol-1
(2)用Cu2Al2O4做催化剂,一定条件下,发生反应:CO2+CH4 CH3COOH, 温度与催化剂的催化效率和乙酸的生成速率如图,
CH3COOH, 温度与催化剂的催化效率和乙酸的生成速率如图,
请回答下列问题:
①250~300℃时,温度升高而乙酸的生成速率降低的原因是____ 。
②为提高上述反应CH4的转化率,可采取的措施有 (写2种)。
(3)Li4SiO4可用于吸收、释放CO2,原理是: 500℃时,CO2与Li4SiO4接触生成Li2CO3;平衡后加热至700℃,反应逆向进行,放出CO2,Li4SiO4再生,将该原理用化学方程式表示(请注明正反应方向和逆反应方向的条件): 。
(4)钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2Sx)分别作为两个电极的反应物,多孔固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如下图所示:
①根据下表数据,请你判断该电池工作的适宜温度应控制在 范围内(填字母序号)。
| 物质 |
Na |
S |
Al2O3 |
| 熔点/℃ |
97.8 |
115 |
2050 |
| 沸点/℃ |
892 |
444.6 |
2980 |
a.100℃以下 b.100℃~300℃ c.300℃~350℃ d.350℃~2050℃
②放电时,电极A为 极。
③放电时,内电路中Na+的移动方向为 (填“从A到B”或“从B到A”)。
④充电时,总反应为Na2Sx =" 2Na" + xS(3<x<5),则阳极的电极反应式为 .
 HSO3-+OH-水解平衡的事实是 (填序号)。
HSO3-+OH-水解平衡的事实是 (填序号)。
 2C ( g ) + D ( s)反应,按下表数据投料,反应达到平衡状态,测得体系压强升高。简述该反应的平衡常数与温度的变化关系:
2C ( g ) + D ( s)反应,按下表数据投料,反应达到平衡状态,测得体系压强升高。简述该反应的平衡常数与温度的变化关系:


 +2I―。相关物质的溶度积常数见下表:
+2I―。相关物质的溶度积常数见下表:
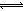 HOI(aq)△H2
HOI(aq)△H2
 粤公网安备 44130202000953号
粤公网安备 44130202000953号