电解原理在化学工业中有广泛应用。右图表示一个电解池,
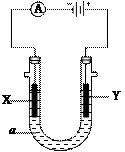
装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。
请回答以下问题:
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同
时在两边各滴入几滴酚酞试液,则
①Y电极上的电极反应式为,
检验该电极反应产物的方法是。
②电解池中X极上的电极反应式为。
在X极附近观察到的现象是。
③电解一段时间后,若收集到H2为2L,则同样条件下收集的Cl22L(填“>”“<”“=”),
原因是。
(2)如果在铁件的表面镀铜防止铁被腐蚀,电解液a选用CuSO4溶液,请回答:
①X电极对应的金属是______(写元素名称),其电极反应式。
②若电镀前铁、铜两片金属质量相同,电镀完成后将它们取出洗净、烘干、称量,二
者质量差为5.12 g,则电镀时电路中通过的电子为________________mol。
③镀层破损后,镀铜铁比镀锌铁更容易被腐蚀,请简要说明原因
。