(10+2分)某化学兴趣小组同学展开对漂白剂亚氯酸钠(NaClO2)的研究。
实验Ⅰ:制取NaClO2晶体
已知:NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2•3H2O,高于38℃时析出晶体的是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。Ba(ClO)2可溶于水。利用下图所示装置进行实验。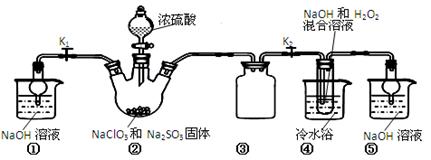
(1)装置①的作用是 装置③的作用是 。
(2)装置②中产生ClO2气体的化学方程式为 。
(3)从装置④反应后的溶液获得晶体NaClO2的操作步骤为:
①减压,55℃蒸发结晶;
②趁热过滤;
③ ;
④低于60℃干燥,得到成品。
实验Ⅱ:测定某亚氯酸钠样品的纯度。设计如下实验方案,并进行实验:
①准确称取所得亚氯酸钠样品m g于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(已知:ClO2-+ 4I-+4H+ =2H2O+2I2+Cl-)。将所得混合液配成100mL待测溶液。
②移取25.00mL待测溶液于锥形瓶中,用c mol•L-1 Na2S2O3标准液滴定,至滴定终点。重复2次,测得消耗标准溶液的体积的平均值为V mL(已知:I2 +2S2O32-=2I-+S4O62-)。
样品中NaClO2的质量分数为 (用含m、c、V的代数式表示)。


 。
。
 ______(填序号),还缺少的仪器有。
______(填序号),还缺少的仪器有。
 cm-3,沸点131.4℃,熔点9.79℃,难溶于水,易溶于醇,醚,丙酮等有机溶剂。在实验室中可用如下图所示设备制备1,2-二溴乙烷。图中分液漏斗和烧瓶a中装有乙醇和浓硫酸的混合液,试管d中装有液溴(表面覆盖少量水),据此请回答下列问题:
cm-3,沸点131.4℃,熔点9.79℃,难溶于水,易溶于醇,醚,丙酮等有机溶剂。在实验室中可用如下图所示设备制备1,2-二溴乙烷。图中分液漏斗和烧瓶a中装有乙醇和浓硫酸的混合液,试管d中装有液溴(表面覆盖少量水),据此请回答下列问题: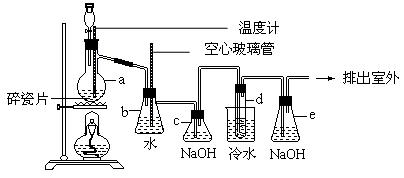
 粤公网安备 44130202000953号
粤公网安备 44130202000953号