(9分)有机物A的结构简式为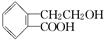 ,它可通过不同化学反应分别制得B、C和D三种物质.
,它可通过不同化学反应分别制得B、C和D三种物质.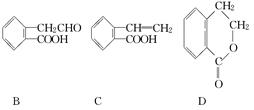
(1)B中含氧官能团的名称是________.
(2)A→C的反应类型是________;A~D中互为同分异构体的是________.
(3)由A生成B的化学方程式是______________________________________.
(9分)有机物A的结构简式为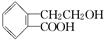 ,它可通过不同化学反应分别制得B、C和D三种物质.
,它可通过不同化学反应分别制得B、C和D三种物质.
(1)B中含氧官能团的名称是________.
(2)A→C的反应类型是________;A~D中互为同分异构体的是________.
(3)由A生成B的化学方程式是______________________________________.