下列化学反应的离子方程式正确的是
A.往明矾溶液中逐滴加入氢氧化钡溶液至SO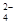 恰好完全沉淀Al3+ + 2 SO 恰好完全沉淀Al3+ + 2 SO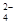 +2 Ba2+ + 4 OH— =" 2" BaSO4 +2 Ba2+ + 4 OH— =" 2" BaSO4 + AlO2— + 2 H2O + AlO2— + 2 H2O |
B.少量SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-=CaSO3 +2HClO +2HClO |
C.用稀HNO3溶液溶解FeS固体:FeS+2H+=Fe2++H2S |
D.AgNO3溶液中加入过量的氨水:Ag++NH3·H2O=AgOH +NH4+ +NH4+ |
下列化学反应的离子方程式正确的是
A.往明矾溶液中逐滴加入氢氧化钡溶液至SO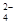 恰好完全沉淀Al3+ + 2 SO 恰好完全沉淀Al3+ + 2 SO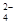 +2 Ba2+ + 4 OH— =" 2" BaSO4 +2 Ba2+ + 4 OH— =" 2" BaSO4 + AlO2— + 2 H2O + AlO2— + 2 H2O |
B.少量SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-=CaSO3 +2HClO +2HClO |
C.用稀HNO3溶液溶解FeS固体:FeS+2H+=Fe2++H2S |
D.AgNO3溶液中加入过量的氨水:Ag++NH3·H2O=AgOH +NH4+ +NH4+ |