从环己烷可制备1,4-环己二醇,下列有关7步反应(其中无机产物都已略去),试回答:
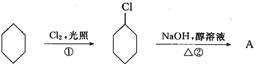
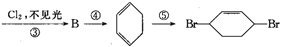
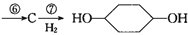
(1)化合物的结构简式:B ,C 。
(2)②的反应类型是 ;③的反应类型是 ;
(3)反应⑥所用试剂和条件是 。
从环己烷可制备1,4-环己二醇,下列有关7步反应(其中无机产物都已略去),试回答:



(1)化合物的结构简式:B ,C 。
(2)②的反应类型是 ;③的反应类型是 ;
(3)反应⑥所用试剂和条件是 。