(10分)合成氨反应原理为:N2(g)+3H2(g)  2NH3(g) ΔH=-92.4 kJ·mol-1 一种工业合成氨的简易流程图如下:
2NH3(g) ΔH=-92.4 kJ·mol-1 一种工业合成氨的简易流程图如下: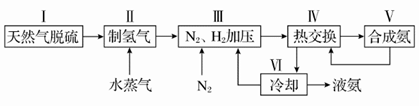
(1)步骤Ⅱ中制氢气原理如下:
①CH4(g)+H2O(g)  CO(g)+3H2(g) ΔH=+206.4 kJ·mol-1
CO(g)+3H2(g) ΔH=+206.4 kJ·mol-1
②CO(g)+H2O(g)  CO2(g)+H2(g) ΔH=-41.2 kJ·mol-1
CO2(g)+H2(g) ΔH=-41.2 kJ·mol-1
对于反应①,一定可以提高平衡体系中H2百分含量,又能加快反应速率的措施是 ________。
a.升高温度 b.增大水蒸气浓度 c.加入催化剂 d.缩小容器的体积
利用反应②,将CO进一步转化,可提高H2产量。若2 mol CO和H2的混合气体(CO的体积分数为20%)与H2O反应,得到2.2 mol CO、CO2和H2的混合气体,则CO转化率为________。
(2)图中表示500℃、60.0 MPa条件下,原料气投料比与平衡时NH3体积分数的关系。根据图中a点数据计算H2的平衡体积分数:________。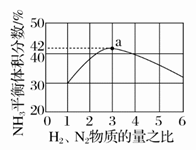
(3)上述流程图中,使合成氨放出的能量得到充分利用的主要步骤是(填序号)________。简述两点本流程中提高合成氨原料总转化率的方法:_______________________________________。
 4Al(OH)3↓+4NaOH+O2↑+2H2↑
4Al(OH)3↓+4NaOH+O2↑+2H2↑
 CO(g)+3H2(g) ΔH=+206.0 kJ·mol-1
CO(g)+3H2(g) ΔH=+206.0 kJ·mol-1

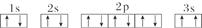
 Na2S(s) + 4H2O(g) ,已知该反应的平衡常数K1000℃<K1400℃,则该反应的△H______0(填“>”“=”或“<”)。
Na2S(s) + 4H2O(g) ,已知该反应的平衡常数K1000℃<K1400℃,则该反应的△H______0(填“>”“=”或“<”)。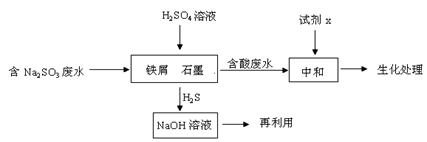
 粤公网安备 44130202000953号
粤公网安备 44130202000953号