在下图所示的物质转化关系中,A是用于制造汽车发动机的耐高温陶瓷材料,A由两种元素组成,且两种元素化合价的绝对值相等。常温下,C、F、K是无色无味的气体单质,D、H是固体单质。E是常见的两性氧化物。B、G是汽车尾气中的主要污染气体,所含元素均为第二周期元素。反应②常用于汽车尾气的处理。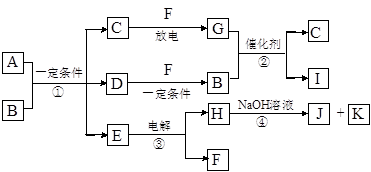
(1)C的电子式 。
(2)A的化学式 。
(3)反应③的化学方程式 。
(4)反应④的离子方程式 。
在下图所示的物质转化关系中,A是用于制造汽车发动机的耐高温陶瓷材料,A由两种元素组成,且两种元素化合价的绝对值相等。常温下,C、F、K是无色无味的气体单质,D、H是固体单质。E是常见的两性氧化物。B、G是汽车尾气中的主要污染气体,所含元素均为第二周期元素。反应②常用于汽车尾气的处理。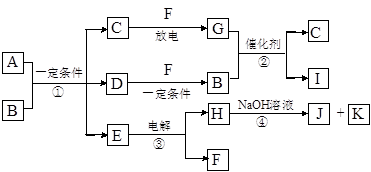
(1)C的电子式 。
(2)A的化学式 。
(3)反应③的化学方程式 。
(4)反应④的离子方程式 。