要配制450mL 0.2mol•L-1FeSO4溶液,实验操作步骤有:①在天平上称取a g绿矾(FeSO4•7H2O),将它放在烧杯中,用适量蒸馏水使其完全溶解 ②将所得溶液沿玻璃棒注入500mL容量瓶中③继续向容量瓶中加水至液面距刻度线1–2cm处,改用胶头滴管滴加蒸馏水至凹液面底部与刻度线相切④用少量水洗涤烧杯和玻璃棒2-3次,每次洗液都转入容量瓶⑤将容量瓶塞紧,充分摇匀
填写下列空白
(1)a g绿矾的实际质量为____________g。
(2)上述操作步骤的正确顺序为__________________。
(3)下列操作会使所配溶液的浓度偏高的是__________。
| A.若配制时遗漏步骤④; |
B.定容时俯视刻度线; |
| C.称量时物、码放反了; |
D.绿矾样品已部分风化 |
E.摇匀后溶液低于刻度线,再加入蒸馏水使液面最低点与刻度线相切;
F.引流时玻璃棒靠在刻度线上方
(4)取一定体积所配制硫酸亚铁的溶液,用一定浓度的酸性KMnO4标准溶液进行滴定,滴定过程中______(需要或不需要)指示剂,并说明理由_________________________________________。
Ⅱ. 三氟化氮(NF3)是一种新型的电子材料,它在潮湿的空气中与水蒸气能发生氧化还原反应,其生成物有HF、NO、HNO3。根据要求回答下列问题:
(1)写出该反应的化学方程式:_________________________________________。反应过程中,被氧化与被还原的元素物质的量之比为______。
(2)若反应中生成0.2mol HNO3,转移的电子数目为______。
 混合溶液,溶液体积为500ml,M、N均为石墨电极,当装置A中Zn棒质量减少6.5g时,N上质量增加____________g;此时,所有电极上总共收集到的气体的总体积为___________L(换算成标准状况下的体积)。
混合溶液,溶液体积为500ml,M、N均为石墨电极,当装置A中Zn棒质量减少6.5g时,N上质量增加____________g;此时,所有电极上总共收集到的气体的总体积为___________L(换算成标准状况下的体积)。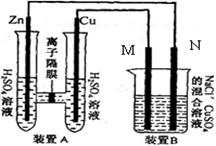
 混合溶液,溶液体积为500ml,M、N均为石墨电极,当装置A中Zn棒质量减少6.5g时,N上质量增加____________g;此时,所有电极上总共收集到的气体的总体积为___________L(换算成标准状况下的体积)。
混合溶液,溶液体积为500ml,M、N均为石墨电极,当装置A中Zn棒质量减少6.5g时,N上质量增加____________g;此时,所有电极上总共收集到的气体的总体积为___________L(换算成标准状况下的体积)。