低碳经济呼唤新能源和清洁环保能源。煤化工中常需研究不同温度下的平衡常数、投料比及热值等问题。
已知:CO(g)+H2O(g) H2(g)+CO2(g)的平衡常数随温度的变化如下表:
H2(g)+CO2(g)的平衡常数随温度的变化如下表:
| 温度/℃ |
400 |
500 |
850 |
| 平衡常数 |
9.94 |
9 |
1 |
请回答下列问题:
(1)该反应逆反应的化学平衡常数表达式为K = 。
(2)上述正反应方向是 反应(填“放热”或“吸热”)。
(3)850℃时在体积为10L反应器中,通入一定量的CO和H2O(g)发生上述反应,CO和H2O(g)浓度变化如下图,则0~4 min的平均反应速率v(CO)= mol·L-1·min-1。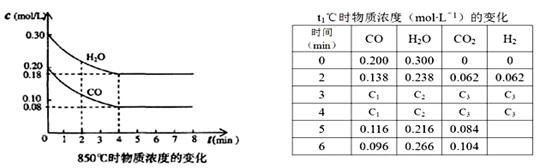
(4)t1℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如表。
①表中3 min~4 min之间反应处于 状态;C1数值 0.08 mol·L-1(填大于、小于或等于)。
②反应在4 min~5 min,平衡向逆方向移动,可能的原因是 (单选),表中5 min~6 min之间数值发生变化,可能的原因是 (单选)。
A.增加水蒸气 B.降低温度 C.使用催化剂 D.增加氢气浓度
(5)若在500℃时进行,若CO、H2O的起始浓度均为0.020 mol·L-1,在该条件下,CO的最大转化率为: 。
 、
、 、
、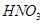 、
、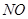 、
、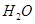 。则该反应中还原产物是______;若反应过程中转移了0.3
。则该反应中还原产物是______;若反应过程中转移了0.3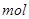 电子,则氧化产物的质量_____
电子,则氧化产物的质量_____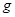 。
。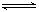 Al(OH)4― + H+;②NH3+H2O
Al(OH)4― + H+;②NH3+H2O

 粤公网安备 44130202000953号
粤公网安备 44130202000953号