(11分)研究NO2、SO2、CO等大气污染气体的处理具有重要意义。
(1)利用以下反应可处理NO2:6NO2+8NH3 7N2+12H2O ΔH< 0。请在答题卡的坐标图中,画出上述反应在有催化剂和无催化剂两种情况下反应过程中体系能量变化的示意图,并标明反应热。
7N2+12H2O ΔH< 0。请在答题卡的坐标图中,画出上述反应在有催化剂和无催化剂两种情况下反应过程中体系能量变化的示意图,并标明反应热。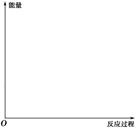
(2)已知:2SO2(g)+O2(g) 2SO3(g) ΔH =-196.6 kJ·mol-1
2SO3(g) ΔH =-196.6 kJ·mol-1
2NO(g)+O2(g) 2NO2(g) ΔH =-113.0 kJ·mol-1
2NO2(g) ΔH =-113.0 kJ·mol-1
写出1mol SO2与足量NO2反应转变成SO3(g)的热化学方程式 。
(3)一定条件下,将NO2与SO2以体积比1∶2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是__________________。
a.体系压强保持不变
b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变
d.每消耗1 mol SO3的同时生成1 mol NO2
测得上述反应平衡时NO2与SO2体积比为1∶6,则平衡常数K=_____(结果取三位有效数字)。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号