某温度时,在2 L的密闭容器中,M、N两种物质的量随时间的变化曲线如下图所示。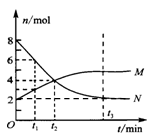
(1)达到平衡时N的转化率是
(2)由图中所给数据进行分析,该反应的化学方程式为 ;
(3)若t2=2,则反应从开始至2分钟末,用M的浓度变化表示的平均反应速率为 v(M)= ;
某温度时,在2 L的密闭容器中,M、N两种物质的量随时间的变化曲线如下图所示。
(1)达到平衡时N的转化率是
(2)由图中所给数据进行分析,该反应的化学方程式为 ;
(3)若t2=2,则反应从开始至2分钟末,用M的浓度变化表示的平均反应速率为 v(M)= ;