计算多元弱酸(HnX)溶液的c(H+)及比较弱酸的相对强弱时,通常只考虑第一步电离。回答下列关于多元弱酸HnX的问题。
(1)若要使HnX溶液中c(H+)/c(HnX)增大,可以采取的措施是 。
A.升高温度 B.加少量固态HnX C.加少量NaOH溶液 D.加水
(2)用离子方程式解释NanX呈碱性的原因: 。
(3)若HnX为H2C2O4,且某温度下,H2C2O4的K1=5×10-2、K2=5×10-5.则该温度下,0.2mol/L H2C2O4溶液 中c(H+)约为 mol/L。(已知
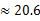 )
)
(4)已知KHC2O4溶液呈酸性。
①KHC2O4溶液中,各离子浓度由大到小的顺序是 。
②在KHC2O4溶液中,各粒子浓度关系正确的是 。
A.c(C2O42-)<c(H2C2O4)
B.c(OH-)=c(H+)+c(HC2O4-)+2c(H2C2O4)
C.c(K+)+c(H+)=c(OH-)+c(HC2O4-)+2c(C2O42-)
D.c(K+)= c(C2O42-)+ c(HC2O4-)+ c(H2C2O4)




 原因是。
原因是。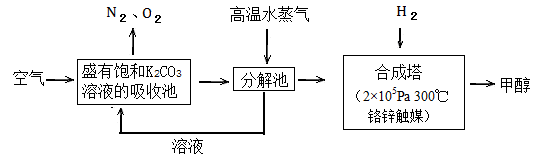
 恰好完全反应,生成气态的水和甲醇,可放出2473.5kJ的热量,试写出合成塔中发生反应的热化学方程式。
恰好完全反应,生成气态的水和甲醇,可放出2473.5kJ的热量,试写出合成塔中发生反应的热化学方程式。 CH3OH(g);CO的转化率(α)与温度、压强的关系如下图所示。
CH3OH(g);CO的转化率(α)与温度、压强的关系如下图所示。
 (答出两点即可)。
(答出两点即可)。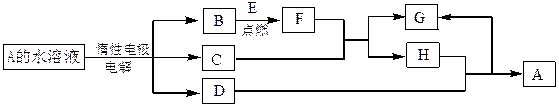 (1)B的同素异形体的名称为_________;F的化学式为__________。
(1)B的同素异形体的名称为_________;F的化学式为__________。 状况下的气体体积为_____________。
状况下的气体体积为_____________。 粤公网安备 44130202000953号
粤公网安备 44130202000953号