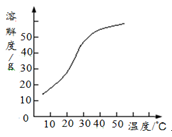
(1) 由氢气和氧气反应生成1mol水蒸气放热241.8kJ,写出该反应的热化学方程式: _ 。
若1g水蒸气转化成液态水放热2.444kJ,则氢气的燃烧热为_____________。
(2)已知①CO(g) + 1/2 O2(g) = CO2(g) ; ΔH1= -283.0 kJ/mol
②H2(g) + 1/2 O2(g) = H2O(l) ; ΔH2= -285.8 kJ/mol
③C2H5OH(l) + 3 O2(g) = 2 CO2(g) + 3H2O(l); ΔH3="-1370" kJ/mol
试写出一氧化碳与氢气反应生成液态水和乙醇液体的热化学方程式:
___________________________________________________________。
(3)Fe(s)+CO2(g) FeO(s)+CO(g) ΔH=a kJ·mol-1,平衡常数为K,测得在不同
FeO(s)+CO(g) ΔH=a kJ·mol-1,平衡常数为K,测得在不同
温度下,K值如下:
| 温度/℃ |
500 |
700 |
900 |
| K |
1.00 |
1.47 |
2.40 |
①若500℃时进行反应,CO2起始浓度为2 mol·L-1,CO的平衡浓度为________。
②此反应焓变中的a________0(填大于、小于、等于)。

 CO2(g)+H2(g)
CO2(g)+H2(g)
 C6H12O6+6O2
C6H12O6+6O2 C2H5OH +3H2O
C2H5OH +3H2O CH3COOH
CH3COOH  CH2=CH2 + 4H2O
CH2=CH2 + 4H2O 键的物质的量为。
键的物质的量为。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号