对于弱酸,在一定温度下达到电离平衡时,各微粒的浓度存在着一种定量关系:如25 ℃时,HA H++A-,则K=
H++A-,则K= ,式中K为电离平衡常数,只与温度有关,c为平衡浓度。下表是几种弱酸的电离平衡常数(25 ℃)。
,式中K为电离平衡常数,只与温度有关,c为平衡浓度。下表是几种弱酸的电离平衡常数(25 ℃)。
| 酸 |
电离方程式 |
电离平衡常数K |
| CH3COOH |
CH3COOH H++CH3COO- |
1.75×10-5 |
| H2CO3 |
H2CO3 H++HCO3- H++HCO3-HCO3-  H++CO32- H++CO32- |
K1=4.4×10-7 K2=4.7×10-11 |
| H2S |
H2S H++HS- H++HS-HS-  H++S2- H++S2- |
K1=1.3×10-7 K2=7.1×10-15 |
| H3PO4 |
H3PO4 H++H2PO4- H++H2PO4-H2PO4-  H++HPO42- H++HPO42-HPO42-  H++PO43- H++PO43- |
K1=7.1×10-3 K2=6.3×10-8 K3=4.2×10-13 |
回答下列问题:
(1)K只与温度有关,当温度升高时,K值________(填“变大”、“变小”或“不变”)。
(2)在温度相同时,各弱酸的K值不同,那么K值的大小与酸性相对强弱的关系是_____________________________________________________________。
(3)若把CH3COOH、H2CO3、HCO3-、H2S、HS-、H3PO4、H2PO4-、HPO42-都看成酸,其中酸性最强的是________,酸性最弱的是________。
(4)多元弱酸是分步电离的,每一步都有相应的电离平衡常数,对于同一种多元弱酸的K1、K2、K3,总有: ,产生此现象的原因是________________________________________________________________________。
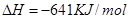
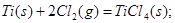
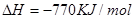
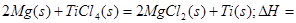 ____________
____________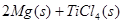
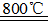
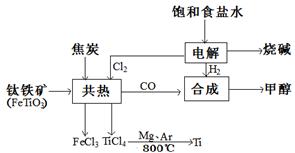
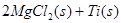 在Ar气氛中进行的理由是________
在Ar气氛中进行的理由是________ C(s)=
C(s)= 2Fe(s)+3CO2(g);工业上有16 t Fe2O3在200m3的容器中反应,l小时后测得Fe2O3的转化率为50%,则这段时间内CO的消耗速率为mol/(L·h).
2Fe(s)+3CO2(g);工业上有16 t Fe2O3在200m3的容器中反应,l小时后测得Fe2O3的转化率为50%,则这段时间内CO的消耗速率为mol/(L·h). Fe(OH)2+Ni(OH)2;高铁酸钠( Na2FeO4)是一种新型饮水消毒剂.用题29图装置可以制取少量高铁酸钠.
Fe(OH)2+Ni(OH)2;高铁酸钠( Na2FeO4)是一种新型饮水消毒剂.用题29图装置可以制取少量高铁酸钠.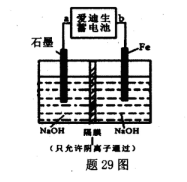
 RCH2OH, RX
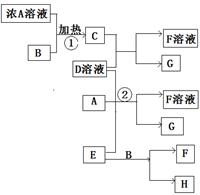
RCH2OH, RX RCOOH.有机化合物A可发生如题28-1图转化关系(无机产物略去),其中G与FeC13溶液能发生显色反应,且环上的一元取代产物只有两种结构.
RCOOH.有机化合物A可发生如题28-1图转化关系(无机产物略去),其中G与FeC13溶液能发生显色反应,且环上的一元取代产物只有两种结构.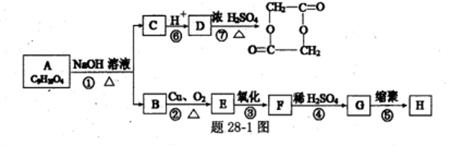
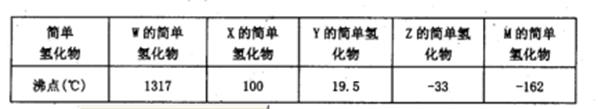
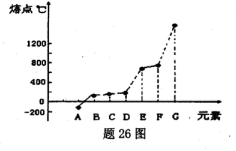
 粤公网安备 44130202000953号
粤公网安备 44130202000953号