有机物F是有机合成工业中一种重要的中间体。以甲苯和丙烯为起始原料合成F的工艺流程如下: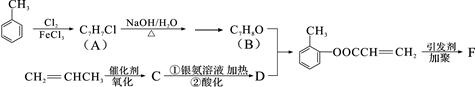
回答下列问题:
(1)化合物B中的含氧官能团名称是 。F的结构简式为 。
(2)写出C与银氨溶液共热的化学反应方程式: 。
(3)化合物D不能发生的反应有 (填序号)。
①加成反应 ②取代反应 ③消去反应 ④氧化反应 ⑤水解反应
(4)B的含苯环结构的同分异构体还有 种,其中一种的核磁共振氢谱中出现4个峰且不与FeCl3溶液发生显色反应的是 (填结构简式)。
有机物F是有机合成工业中一种重要的中间体。以甲苯和丙烯为起始原料合成F的工艺流程如下:
回答下列问题:
(1)化合物B中的含氧官能团名称是 。F的结构简式为 。
(2)写出C与银氨溶液共热的化学反应方程式: 。
(3)化合物D不能发生的反应有 (填序号)。
①加成反应 ②取代反应 ③消去反应 ④氧化反应 ⑤水解反应
(4)B的含苯环结构的同分异构体还有 种,其中一种的核磁共振氢谱中出现4个峰且不与FeCl3溶液发生显色反应的是 (填结构简式)。