在北方,常用乙二醇作内燃机的抗冻剂。某种合成乙二醇的路径如下图所示:
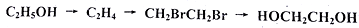
(1)按先后顺序,依次完成上图中每步反应的化学方程式:
①_______________________________________
②_______________________________________
③_______________________________________
(2)一定条件下,乙二醇可以被氧化为乙二醛,反应方程式为:______________________________
(3)CH2BrCH2Br有一同分异构体,其结构简式为:______________________________