.已知化合物A的分子式为C4H6O2,不溶于水,并可以发生如下图所示的变化: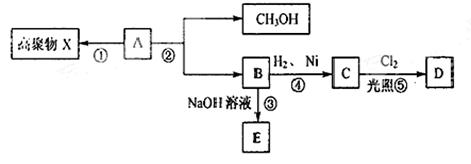
已知:C物质的一氯代物D只有两种同分异构体。请回答:
(1)A分子中含有的官能团的名称 。
(2)②属于 反应(反应类型)
(3)写出②的反应方程式 。
(4)写出C的同分异构体中属于酯且能发生银镜反应的结构简式
.已知化合物A的分子式为C4H6O2,不溶于水,并可以发生如下图所示的变化:
已知:C物质的一氯代物D只有两种同分异构体。请回答:
(1)A分子中含有的官能团的名称 。
(2)②属于 反应(反应类型)
(3)写出②的反应方程式 。
(4)写出C的同分异构体中属于酯且能发生银镜反应的结构简式