(16分)铜及其化合物在生产和生活实际中应用广泛。
Ⅰ.某学习小组对粗铜提纯(电解精炼)后的阳极泥(主要成分为银、金)进行如下实验。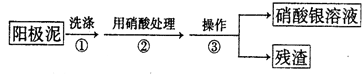
(1)操作③所需的仪器有:烧杯、 。
(2)稀硝酸处理阳极泥得到硝酸银稀溶液,写出该步反应的化学方程式_____ _。
(3)为了回收金,他们查阅了有关资料如下表:
| 编号 |
常温下反应 |
化学平衡常数 |
| 反应1 |
Au + 6HNO3  Au(NO3)3 + 3NO2↑+ 3H2O Au(NO3)3 + 3NO2↑+ 3H2O |
<10−5 |
| 反应2 |
Au3+ + Cl− [AuCl4]− [AuCl4]− |
>105 |
从资料中可知,常温下金很难与硝酸反应,但却可溶于王水(浓硝酸与浓盐酸体积比为1∶3的混合物)。请你运用化学平衡移动原理,简要说明金能溶于王水的原因: 。
Ⅱ.实验室用铜制备CuSO4溶液有多种方案,某实验小组给出了以下三种方案:
请回答有关问题: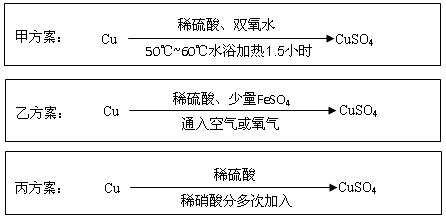
(4)甲方案:将6.4g铜丝放到90 mL 1.5 mol·L-1的稀硫酸中,控温在50℃。加入40 mL 10%的H2O2,反应0.5小时,升温到60℃,持续反应1小时后,经一系列操作,得CuSO4·5H2O 20.0 g【已知有关摩尔质量:M(Cu)="64" g/mol, M(CuSO4·5H2O) ="250" g/mol】。
①反应时温度控制在50℃~60℃,不宜过高的原因是 ;
②本实验CuSO4·5H2O的产率为 。
(5)乙方案:将空气或氧气直接通入到铜粉与稀硫酸的混合物中,发现在常温下几乎不反应。向反应液中加少量FeSO4,即发生反应,生成硫酸铜。反应完全后,加物质A调节pH至4 ,然后过滤、浓缩、结晶。
①物质A可选用以下的 (填序号);
A.CaO B.NaOH C.CuCO3 D.Cu2(OH)2CO3 E.Fe2(SO4)3
②反应中加入少量FeSO4可加速铜的氧化,FeSO4的作用是 ;
(6)丙方案:为了节约原料,硫酸和硝酸的物质的量之比最佳为,n(H2SO4):n(HNO3)= 。

 ______+______
______+______ 粤公网安备 44130202000953号
粤公网安备 44130202000953号