某同学取一定量的Al、Fe混合物,与2.0L极稀的HNO3充分反应,假设HNO3的还原产物全部为铵盐。在反应后的溶液中,逐滴加入4mol·L-1的NaOH溶液,所加NaOH溶液的体积与产生的沉淀的物质的量的关系如图所示。分析图像回答问题: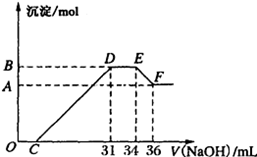
(1)DE段发生反应的离子方程式为:_____________________________________ 。
(2)请写出任意一个Al、Fe与极稀HNO3反应的化学方程式:_______________ 。
(3)B点对应的沉淀的物质的量为_______mol,C点对应的氢氧化钠溶液的体积为______mL。
(4)原硝酸溶液的物质的量浓度为_______mol/L。

 )常用做汽水、糖果的添加剂。
)常用做汽水、糖果的添加剂。
 ”“
”“ ”)。
”)。
 )。
)。


 粤公网安备 44130202000953号
粤公网安备 44130202000953号