请结合化学反应原理回答下列问题:
(1)硫酸的产量通常用来衡量一个国家的化学工业发展水平,硫酸工业生产中涉及反应之一为:
2SO2(g)+O2(g) 2SO3(g),SO2的平衡转化率与温度、压强的关系如右图所示。
2SO3(g),SO2的平衡转化率与温度、压强的关系如右图所示。
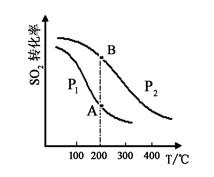
①压强:P1 P2(填“>”、“=”或“<”)。
②200℃下,将一定量的SO2和O2充入体积不变的密闭容器中,经10min后测得容器中各物质的物质的量浓度如下表所示:
| 气体 |
SO2 |
O2 |
SO3 |
| 浓度(mol/L) |
0.4 |
1.2 |
1.6 |
能说明该反应达到化学平衡状态的是 。
a.反应速率υ(SO2)=υ(SO3)
b.体系的压强保持不变
c.混合气体的密度保持不变
d.SO2和O2的体积比保持不变
计算上述反应在0~10min内,υ(SO2)= 。
(2)SO2与氢氧化钠溶液反应可以生成亚硫酸氢钠,已知25℃时,NaHSO3的水解平衡常数=1.0×10-12mol/L,则该温度下H2SO3 HSO3-+H+的电离常数Ka=____mol/L,若向H2SO3溶液中加入少量的I2,则溶液中
HSO3-+H+的电离常数Ka=____mol/L,若向H2SO3溶液中加入少量的I2,则溶液中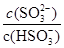 将________(填“增大”、“减小”或“不变”)。
将________(填“增大”、“减小”或“不变”)。
(3)工业制取硫酸还可以利用电化学原理:
①工业生产中用SO2为原料制取硫酸可以利用原电池原理,用SO2、O2和H2O来制备硫酸,该电池用多孔材料作电极,它能吸附气体,同时也能使气体与电解质溶液充分接触。请写出该电池的正极电极反应式_____________。
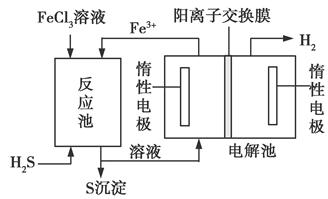
②用Na2SO3溶液充分吸收SO2得NaHSO3溶液,然后电解该溶液可制得硫酸。电解原理示意图如下图所示。请写出开始时阳极反应的电极反应式_________。


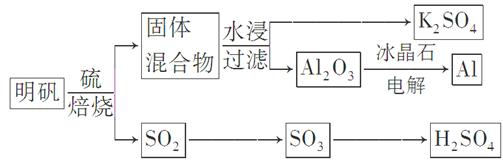 焙烧明矾的化学方程式为:4KAl(SO4)2·12H2O+3S=2K2SO4+2Al2O3+9SO2↑+48H2O
焙烧明矾的化学方程式为:4KAl(SO4)2·12H2O+3S=2K2SO4+2Al2O3+9SO2↑+48H2O
 2SO3(g) ΔH1=-197 kJ/mol;
2SO3(g) ΔH1=-197 kJ/mol; H2(g)+
H2(g)+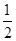 S2(g)
S2(g)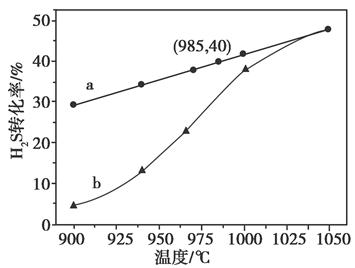
 粤公网安备 44130202000953号
粤公网安备 44130202000953号