甲醇可作为燃料电池的原料。以CH4和H2O为原料,通过下列反应来制备甲醇。
①:CH4(g)+H2O(g)===CO(g)+3H2(g) ΔH=+206.0 kJ·mol-1
②:CO(g)+2H2(g)===CH3OH(g) ΔH=-129.0 kJ·mol-1
(1)CH4(g)与H2O(g)反应生成CH3OH(g)和H2(g)的热化学方程式为_______________。
(2)将1.0 mol CH4和2.0 mol H2O(g)通入容积为100 L的反应室中,在一定条件下发生反应Ⅰ,测得在一定的压强下CH4的转化率与温度的关系如右图。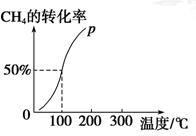
①假设100 ℃时达到平衡所需的时间为5 min,则用H2表示该反应的平衡反应速率为________________。
②100 ℃时反应Ⅰ的平衡常数为__________________。
(3)在压强为0.1 MPa、温度为300 ℃条件下,将a mol CO与3a mol H2的混合气体在催化剂作用下发生反应Ⅱ生成甲醇,平衡后将容器的容积压缩到原来的1/2,其他条件不变,对平衡体系产生的影响是________(填字母序号)。
| A.c(H2)减小 | B.正反应速率加快,逆反应速率减慢 |
| C.CH3OH的物质的量增加 | D.重新平衡c(H2)/c(CH3OH)减小 |
E.平衡常数K增大
 。
。 D三种元素按金属性由强到弱的顺序排列为。
D三种元素按金属性由强到弱的顺序排列为。 SiC+2CO。在该反应中氧化剂和还原剂的物质的量比为。
SiC+2CO。在该反应中氧化剂和还原剂的物质的量比为。
 为5. 71g·cm-3,晶胞边长为4.28×10-10m(Ni的相对原子质量为58.7,O的相对原子质量为16)。求:(已知:4.283="78.4"
为5. 71g·cm-3,晶胞边长为4.28×10-10m(Ni的相对原子质量为58.7,O的相对原子质量为16)。求:(已知:4.283="78.4" 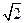 =1.4)
=1.4) 粤公网安备 44130202000953号
粤公网安备 44130202000953号