将1.00 mol二氧化硫和1.00 mol氧气通入1.00 L的密闭容器中,分别在500 K,600 K,700 K三个不同的温度下进行2SO2+O2 2SO3反应,反应过程中SO3浓度随时间的变化如下面表格所示:
2SO3反应,反应过程中SO3浓度随时间的变化如下面表格所示:
表一:500 K
| 时间(min) |
0 |
5 |
10 |
15 |
20 |
25 |
| SO3浓度(mol·L-1) |
0 |
0.10 |
0.15 |
0.20 |
0.25 |
0.30 |
| 时间 |
30 |
35 |
40 |
45 |
50 |
55 |
| SO3浓度(mol·L-1) |
0.35 |
0.40 |
0.50 |
0.55 |
0.60 |
0.60 |
表二:600 K
| 时间(min) |
0 |
5 |
10 |
15 |
20 |
25 |
| SO3浓度(mol·L-1) |
0 |
0.20 |
0.30 |
0.40 |
0.50 |
0.50 |
表三:700 K
| 时间(min) |
0 |
5 |
10 |
15 |
20 |
25 |
| SO3浓度(mol·L-1) |
0 |
0.25 |
0.35 |
0.35 |
0.35 |
0.35 |
(1)从上面三个表的数据可以判断该反应是__________反应(填“吸热”或“放热”),利用表一计算0~40 min内用SO2表示该反应的化学反应速率v(SO2)=__________mol·L-1·min-1。
(2)对该反应,下面的说法正确的是__________。
A.当容器中的压强不再变化时,该反应就达到平衡
B.达到平衡时v正(SO2)=v逆(SO3)
C.平衡时c(SO2)=c(SO3)
D.当由500 K平衡状态时升高温度至600 K时,重新达到平衡状态时,容器的压强减小
(3)从上面三个表的数据,温度对该反应的反应速率和平衡移动的影响是___________________。
(4)计算在600 K时的平衡常数_______(写出计算过程,最后结果取两位有效数字)。
(5)下图曲线(Ⅰ)是在500 K时SO3浓度的变化曲线,请你在图中画出在550 K进行上述反应的曲线,并标明曲线(Ⅱ)。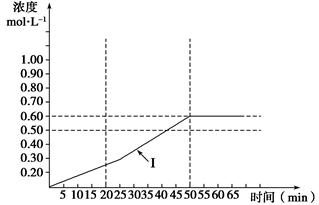


 。
。 程式
程式 。
。 Al(OH)4- + H+ ②NH3+H2O
Al(OH)4- + H+ ②NH3+H2O

 。
。 Fe2+的配位键。
Fe2+的配位键。

 粤公网安备 44130202000953号
粤公网安备 44130202000953号